Pengertian enzim
Enzim atau sering disebut biokatalisator adalah suatu senyawa organik yang dihasilkan oleh organisme hidup. Enzim diproduksi di dalam sel - sel hidup dan dapat bekerja di dalam sel sehingga disebut enzim intraseluler (endoenzim). Contohnya enzim katalase dan heksokinase. Sedangkan beberapa enzim lain melakukan fungsinya di luar sel sehingga disebut enzim ekstraseluler (eksoenzim). Contohnya enzim - enzim pencernaan. Proses metabolisme sangat bergantung kepada peranan enzim. Ada banyak reaksi - reaksi yang dikendalikan oleh enzim misalnya proses pertumbuhan, perkembangan, respirasi, fotosintesis, kontraksi otot, pencernaan dan lain - lain.
Struktur enzim
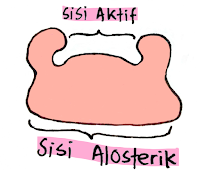
Enzim memiliki dua sisi yaitu :
- Sisi aktif (sisi katalitik) yaitu bagian pada enzim yang berfungsi sebagai tempel menempelnya substrat.
- Sisi alosterik yaitu bagian pada enzim yang mempengaruhi kerja enzim. Ibarat sakelar, jika berikatan pada inhibitor, maka konfigurasi enzim dapat berubah sehingga aktivitasnya berkurang. Namun, jika berikatan dengan aktivator (penggiat), maka aktivitas enzim meningkat.
Enzim tersusun atas bagian protein (apoenzim) dan non protein (kofaktor). Gabungan keduanya sehingga membentuk enzim lengkap atau utuh disebut holoenzim. Apabila bagian enzim dipisahkan, maka enzim tidak aktif. Bagian protein bersifat tidak tahan panas, menentukan kekhususan dari enzim, mudah berubah sehingga non aktif. Sementara bagian non protein (kofaktor) berupa ion/molekul yang membantu kerja enzim untuk menguatkan ikatan dengan substrat, relatif tahan panas/thermostabil. Terdapat 3 tipe kofaktor :
Aktivator
Berupa senyawa anorganik (logam atau non logam), menentukan fungsi enzim.
contoh : Ion Cl-, Ca2+, K+, Mg2+, Na+, Fe2+
Protrombin --> Trombin
Koenzim
Berupa senyawa organik atau derivat vitamin yang terikat renggang dengan enzim. Fungsinya untuk memindahkan gugus kimia, atom, atau elektron dari satu enzim ke enzim lain.
contoh : FAD, NAD, Tiamin Pirofosfat, Asam Tetrahidrofolat, Vitamin (B1, B2, B6, Niasin, Biotin), Koenzim A (Turunan asam Pentotenat)
Gugus Prostetik
Berupa senyawa organik yang terikat kuat pada protein enzim. Fungsi untuk memberi kekuatan tambahan pada kerja enzim. Contoh : Heme pada hemoglobin, Heme pada sejumlah enzim antara lain Katalase, Peroksidase, Sitokrom Oksidase.
Reaksi Pengikatan Enzim dengan Substrat
Enzim bekerja spesifik karena sisi aktifnya sangat selektif terhadap susbtrat (reaktan) yang akan dikatalisis. Ikatan enzim dengan substrat bersifat lemah sehingga reaksi bisa berlangsung bolak balik. Substrat menempel pada sisi aktif enzim dan enzim melakukan fungsinya sehingga terbentuk produk baru. Berikut ilustrasi reaksi pengikatan enzim dengan substrat.
Sifat - Sifat Enzim
- Enzim adalah protein
- Bisa digunakan berkali - kali
- Kerjanya spesifik berarti hanya dapat mengkatalisis reaksi tertentu. Satu jenis enzim hanya bekerja untuk satu jenis reaksi dan pada substrat tertentu saja. Misalnya enzim Katalase hanya mampu menghidrolisis H2O2 --> H2O + O2
- Dapat bekerja bolak - balik (reversible)
- Berperan sebagai biokatalisator yaitu senyawa yang mempercepat reaksi kimia dengan cara menurunkan energi aktivasi. Energi aktivasi adalah energi awal yang dibutuhkan untuk memulai suatu reaksi kimia namun enzim sendiri tidak ikut mengalami reaksi (perubahan). Berikut grafik pengaruh enzim terhadap penurunan energi aktivasi.

- Kerjanya dibantu oleh air (khususnya enzim dalam reaksi hidrolisis)
- Tidak tahan panas sehingga disebut bersifat thermolabil. Sebagian besar enzim akan rusak pada suhu di atas 60℃ karena proteinnya denaturasi.
Enzim bekerja spesifik karena sisi aktifnya sangat selektif terhadap susbtrat (reaktan) yang akan dikatalisis. Ikatan enzim dengan substrat bersifat lemah sehingga reaksi bisa berlangsung bolak balik. Substrat menempel pada sisi aktif enzim dan enzim melakukan fungsinya sehingga terbentuk produk baru. Berikut ilustrasi reaksi pengikatan enzim dengan substrat.
Sifat - Sifat Enzim
- Enzim adalah protein
- Bisa digunakan berkali - kali
- Kerjanya spesifik berarti hanya dapat mengkatalisis reaksi tertentu. Satu jenis enzim hanya bekerja untuk satu jenis reaksi dan pada substrat tertentu saja. Misalnya enzim Katalase hanya mampu menghidrolisis H2O2 --> H2O + O2
- Dapat bekerja bolak - balik (reversible)
- Berperan sebagai biokatalisator yaitu senyawa yang mempercepat reaksi kimia dengan cara menurunkan energi aktivasi. Energi aktivasi adalah energi awal yang dibutuhkan untuk memulai suatu reaksi kimia namun enzim sendiri tidak ikut mengalami reaksi (perubahan). Berikut grafik pengaruh enzim terhadap penurunan energi aktivasi.

- Kerjanya dibantu oleh air (khususnya enzim dalam reaksi hidrolisis)
- Tidak tahan panas sehingga disebut bersifat thermolabil. Sebagian besar enzim akan rusak pada suhu di atas 60℃ karena proteinnya denaturasi.
 |
Mekanisme Teori Kerja Enzim
Teori Lock and Key (Teori Gembok dan Kunci)
Teori Induced Fit (Teori Ketepatan Induksi)Penemu teori ini adalah Daniel Koshland dimana sisi aktif enzim bersifat fleksibel sehingga dapat menyesuaikan dengan substrat. Bukan berarti enzim bisa bekerja pada setiap substrat berbeda namun lebih kepada bagaimana enzim menyesuaiakan sisi aktifnya pada substrat tertentu agar pas dengan substrat sehingga bisa mencapai pengikatan yang optimal.

Teori ketepatan induksi
Faktor - Faktor yang Mempengaruhi Kerja Enzim 1. Temperatur 0℃ : tidak aktif35℃ - 40℃ : Rentang suhu optimal, aktivitas enzim meningkat> 40℃ - 60℃ : aktivitas enzim menurun> 60℃ : aktivitas enzim akan terhenti. Enzim mengalami denaturasi dimana struktur berubah dan rusak sehingga tidak bisa digunakan lagi. Note: Ada bakteri yang dapat hidup di air panas dan memiliki enzim yang bekerja optimal pada suhu 70C
2. pH Setiap enzim bekerja pada kondisi pH yang spesifik. Normalnya pH optimum adalah 6 - 8. Namun, ada beberapa enzim yang aktif pada kondisi asam, misalnya enzim Pepsin. Perubahan pH mengakibatkan terganggunya ikatan hidrogen yang ada pada struktur enzim.
3. Konsentrasi substrat

Penambahan konsentrasi substrat pada awalnya akan meningkatkan laju reaksi. Akan tetapi, setelah konsentrasi substrat dinaikkan lebih lanjut, enzim akan "jenuh" karena sisi aktif enzim terpakai setiap waktu. Pada titik jenuh, laju reaksi tidak akan meningkat meskipun substrat ditambahkan. Dalam kondisi ini, ketika konsentrasi enzim ditambahkan, maka laju reaksi akan meningkat sehingga terbentuk kembali titik jenuh baru.
4. Konsentrasi enzimPenambahan enzim akan meningkatkan laju reaksi secara linear. Namun, jika konsentrasi enzim dan substrat sudah seimbang, laju reaksi akan relatif konstan.
5. Hasil akhir (produk)Jika produk yang dihasilkan lebih banyak dari yang diperlukan, produk tersebut dapat menghambat kerja enzim sehingga disebut feedback inhibitor. Oleh sebab itu, produk tersebut harus diambil terlebih dahulu atau produk harus habis digunakan maka kerja enzim akan kembali normal. Mekanisme ini sangat penting dalam proses metabolisme, yaitu untuk mencegah sel menghabiskan sumber molekul yang berguna menjadi produk yang tidak dibutuhkan. Misalnya peristiwa feedback inhibitor pada pembentukan isoleusin dari Treonin.
6. Zat penggiat (aktivator)Zat penggiat dapat meningkatkan kerja enzim. Contohnya Ni, Co, Mn, Cl, Ca, Mg
7. Zat penghambat (inhibitor) Jenis inhibitor : - Inhibitor irreversible : ikatan antara inhibitor dengan enzim tidak dapat dipisahkan karena ikatan kovalennya kuat. Contoh : Diisoprofilfluorofosfat yang mengikat Asetilkolinesterase pada penderita Alzheimer- Inhibitor reversible : ikatan antara inhibitor dengan enzim dapat dipisahkan. Inhibitor ini dibagi atas 2 yaitu :a. Inhibitor kompetitif Struktur inhibitor mirip dengan substrat sehingga inhibitor dan substrat bersaing untuk mendapatkan sisi aktif enzim. Inhibitor dapat dihilangkan dengan penambahan konsentrasi substrat.
Inhibitor kompetitif
b. Inhibitor non kompetitifInhibitor yang menempati sisi alosterik sehingga mengakibatkan sisi aktif enzim rusak atau berubah sehingga tidak dapat berikatan dengan substrat. Contoh : Penicilin yang menghambat kerja enzim bakteri, pestisida, Ion Ag+, Hg2+, Pb2+

Inhibitor non-kompetitif
c. Inhibitor umpan balikHasil akhir (produk) suatu reaksi dapat menghambat bekerjanya enzim. Akibatnya reaksi kimia akan berjalan lambat. Apabila produk disingkirkan, reaksi akan berjalan lagi.
8. Kadar air Kerja enzim sangat dipengaruhi oleh air. Kadar air yang terlalu rendah dapat membuat enzim tidak aktif. Misalnya dalam perkecambahan. Biji kering tidak akan berkecambah karena enzim tidak aktif sebagai akibat dari rendahnya kadar air. Kadar air yang cukup dapat mengaktifkan enzim kembali.
Jenis - Jenis Enzim
Mekanisme Teori Kerja Enzim
Teori Lock and Key (Teori Gembok dan Kunci)
Teori Induced Fit (Teori Ketepatan Induksi)
Penemu teori ini adalah Daniel Koshland dimana sisi aktif enzim bersifat fleksibel sehingga dapat menyesuaikan dengan substrat. Bukan berarti enzim bisa bekerja pada setiap substrat berbeda namun lebih kepada bagaimana enzim menyesuaiakan sisi aktifnya pada substrat tertentu agar pas dengan substrat sehingga bisa mencapai pengikatan yang optimal.
 |
| Teori ketepatan induksi |
Faktor - Faktor yang Mempengaruhi Kerja Enzim
1. Temperatur
0℃ : tidak aktif
35℃ - 40℃ : Rentang suhu optimal, aktivitas enzim meningkat
> 60℃ : aktivitas enzim akan terhenti. Enzim mengalami denaturasi dimana struktur berubah dan rusak sehingga tidak bisa digunakan lagi.
Note: Ada bakteri yang dapat hidup di air panas dan memiliki enzim yang bekerja optimal pada suhu 70C
2. pH
Setiap enzim bekerja pada kondisi pH yang spesifik. Normalnya pH optimum adalah 6 - 8. Namun, ada beberapa enzim yang aktif pada kondisi asam, misalnya enzim Pepsin. Perubahan pH mengakibatkan terganggunya ikatan hidrogen yang ada pada struktur enzim.
3. Konsentrasi substrat
 |
Penambahan konsentrasi substrat pada awalnya akan meningkatkan laju reaksi. Akan tetapi, setelah konsentrasi substrat dinaikkan lebih lanjut, enzim akan "jenuh" karena sisi aktif enzim terpakai setiap waktu. Pada titik jenuh, laju reaksi tidak akan meningkat meskipun substrat ditambahkan. Dalam kondisi ini, ketika konsentrasi enzim ditambahkan, maka laju reaksi akan meningkat sehingga terbentuk kembali titik jenuh baru.
4. Konsentrasi enzim
Penambahan enzim akan meningkatkan laju reaksi secara linear. Namun, jika konsentrasi enzim dan substrat sudah seimbang, laju reaksi akan relatif konstan.
5. Hasil akhir (produk)
Jika produk yang dihasilkan lebih banyak dari yang diperlukan, produk tersebut dapat menghambat kerja enzim sehingga disebut feedback inhibitor. Oleh sebab itu, produk tersebut harus diambil terlebih dahulu atau produk harus habis digunakan maka kerja enzim akan kembali normal. Mekanisme ini sangat penting dalam proses metabolisme, yaitu untuk mencegah sel menghabiskan sumber molekul yang berguna menjadi produk yang tidak dibutuhkan. Misalnya peristiwa feedback inhibitor pada pembentukan isoleusin dari Treonin.
6. Zat penggiat (aktivator)
Zat penggiat dapat meningkatkan kerja enzim. Contohnya Ni, Co, Mn, Cl, Ca, Mg
7. Zat penghambat (inhibitor)
Jenis inhibitor :
- Inhibitor irreversible : ikatan antara inhibitor dengan enzim tidak dapat dipisahkan karena ikatan kovalennya kuat. Contoh : Diisoprofilfluorofosfat yang mengikat Asetilkolinesterase pada penderita Alzheimer
- Inhibitor reversible : ikatan antara inhibitor dengan enzim dapat dipisahkan. Inhibitor ini dibagi atas 2 yaitu :
a. Inhibitor kompetitif
Struktur inhibitor mirip dengan substrat sehingga inhibitor dan substrat bersaing untuk mendapatkan sisi aktif enzim. Inhibitor dapat dihilangkan dengan penambahan konsentrasi substrat.
 |
| Inhibitor kompetitif |
b. Inhibitor non kompetitif
Inhibitor yang menempati sisi alosterik sehingga mengakibatkan sisi aktif enzim rusak atau berubah sehingga tidak dapat berikatan dengan substrat.
Contoh : Penicilin yang menghambat kerja enzim bakteri, pestisida, Ion Ag+, Hg2+, Pb2+
 |
| Inhibitor non-kompetitif |
c. Inhibitor umpan balik
Hasil akhir (produk) suatu reaksi dapat menghambat bekerjanya enzim. Akibatnya reaksi kimia akan berjalan lambat. Apabila produk disingkirkan, reaksi akan berjalan lagi.
8. Kadar air
Kerja enzim sangat dipengaruhi oleh air. Kadar air yang terlalu rendah dapat membuat enzim tidak aktif. Misalnya dalam perkecambahan. Biji kering tidak akan berkecambah karena enzim tidak aktif sebagai akibat dari rendahnya kadar air. Kadar air yang cukup dapat mengaktifkan enzim kembali.
Jenis - Jenis Enzim
1. Transferase : memindahkan gugus kimia. Contoh: kinase, transminase.2. Oksidoreduktase : untuk reaksi oksidasi dan reduksi. Contoh : dalam reaksi oksidasi ada enzim oksidase dan dalam reaksi reduksi ada enzinm dehidrogenase. 3. Hidrolase : untuk reaksi hidrolisis. Contoh : enzim - enzim pencernaan.4. Isomerase : reaksi untuk membentuk isomer. 5. Liase : reaksi untuk memutus ikatan karbon. Contoh : dekarboksilase.6. Ligase : menggabungkan dua molekul.
1. Transferase : memindahkan gugus kimia. Contoh: kinase, transminase.
2. Oksidoreduktase : untuk reaksi oksidasi dan reduksi. Contoh : dalam reaksi oksidasi ada enzim oksidase dan dalam reaksi reduksi ada enzinm dehidrogenase.
3. Hidrolase : untuk reaksi hidrolisis. Contoh : enzim - enzim pencernaan.
4. Isomerase : reaksi untuk membentuk isomer.
5. Liase : reaksi untuk memutus ikatan karbon. Contoh : dekarboksilase.
6. Ligase : menggabungkan dua molekul.



No comments:
Post a Comment